动力锂电池的基本结构及工作原理

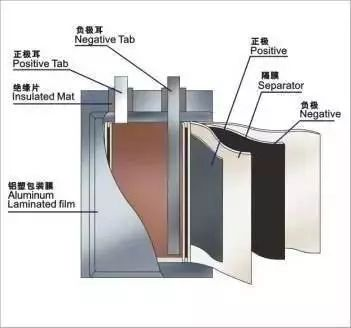
1、锂电池基本结构
主要材料:正极、负极、电解液、隔膜
结构:圆形、方形;叠片、卷绕
形态:聚合物(软包装)、液态锂离子(钢壳)
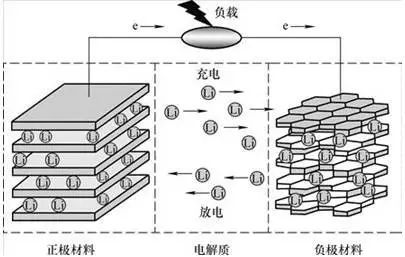
2、锂电池工作原理
正极材料:LiMn2O4,负极材料:石墨
充电时正极的Li+和电解液中的Li+向负极聚集,得到电子,被还原成Li镶嵌在负极的碳素材料中。放电时镶嵌在负极碳素材料中的Li失去电子,进入电解液,电解液内的Li+向正极移动。
3、锂电池组成原理
①正极构造
LiMn2O4(锰酸锂)+导电剂(乙炔黑)+粘合剂(PVDF)+集流体(铝箔)正极
②负极构造
石墨+导电剂(乙炔黑)+粘合剂(PVDF)+集流体(铜箔)负极
4、充电过程
电源给电池充电,此时正极上的电子e从通过外部电路跑到负极上,正锂离子Li+从正极“跳进”电解液里,“爬过”隔膜上弯弯曲曲的小洞,“游泳”到达负极,与早就跑过来的电子结合在一起。
正极上发生的反应为LiMn2O4 ==Li1-xMn2O4+Xli++Xe(电子)
负极上发生的反应为6C+XLi+Xe==LixC6
5、放电过程
电池放电,此时负极上的电子e从通过外部电路跑到正极上,正锂离子Li+从负极“跳进”电解液里,“爬过”隔膜上弯弯曲曲的小洞,“游泳”到达正极,与早就跑过来的电子结合在一起。
正极上发生的反应为Li1-xMn2O4+xli++xe(电子) ==LiMn2O4
负极上发生的反应为LixC6 == 6C+xLi+xe
